Què és la llum?
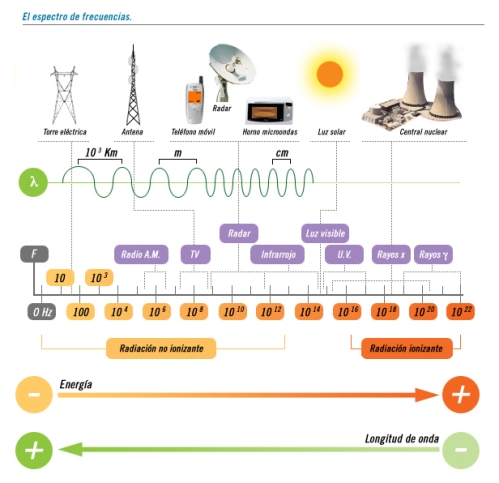
L’espectre electromagnètic.
Ones i partícules.
Sensor lumínic receptor part de l’espectre.
Sensors lumínics en els éssers vius.
Part de l’espectre que reben els satèl·lits.
L’espectre electromagnètic.
L’espectre electromagnètic és el conjunt de totes les freqüències d’ones electromagnètiques possibles. La radiació electromagnètica està formada per fotons.
En un espectre es mostra la descomposició d’una radiació electromagnètica en els seus components: freqüència, longitud d’ona i l’energia dels fotons a través dels que es propaga la radiació. Aquestes tres magnituds estan relacionades per la constant de Planck i per la velocitat de la llum.
Les ones electromagnètiques de major freqüència són els raigs gamma i els raigs X i les de menor freqüència les ones de ràdio. Les freqüències d’ona
Els diferents tipus d’ones electromagnètiques són:
- Ones de ràdio
- Microones
- Raigs T
- Radiació infraroja
- Llum visible
- Radiació ultraviolada
- Raigs X
- Radiació gamma
http://www.afinidadelectrica.com.ar/articulo.php?IdArticulo=95
Atès que els materials tenen diferent absorció de les diverses bandes (vermella, verda, blava, infraroja…) de l’espectre electromagnètic, l’anàlisi de les característiques de la radiació emesa o reflectida (longitud d’ona, intensitat, etc.) pels objectes pot aportar informacions valuoses sobre la seva naturalesa, la temperatura, el tipus de vegetació, etc. Aquesta informació pot ser interpretada per la lectura de les imatges de cada banda o per la seva combinació.
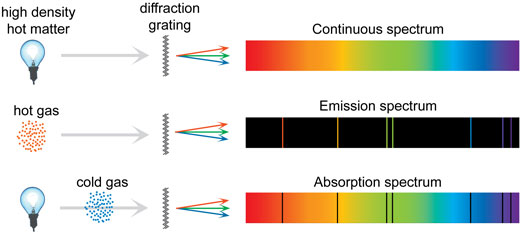
Com es formen els espectres
Alguns dels espectres que poden ser observats amb l’espectròmetre casolà tenen un fons continu, i els colors varien suaument del vermell fosc al blau fosc. Altres estan formats per línies definides en un fons continu, línies definides sense un fons, o fins i tot línies fosques en un fons continu, com en l’espectre solar (veure més a baix ). Per què aquesta diversitat? Com es formen els espectres?
Una mica de sal de taula en la flama d’una espelma produeix una línia d’emissió del sodi
Imatge cortesia de Mark Tiele
Westra
Tot es deu als àtoms. Un àtom individual pot trobar-se en diferents estats d’energia, depenent de si els seus electrons ocupen les seves òrbites usuals o han estat excitats a òrbites més altes. Un àtom no pot tenir qualsevol nivell d’energia: els nivells d’energia estan definits amb precisió per la seva detallada estructura atòmica. Quan un electró salta d’una òrbita a una altra, el canvi correspon a una precisa quantitat d’energia emesa com un sol fotó. L’energia d’aquest fotó emès determina el seu color.
Com pot haver-hi molts salts diferents, cada àtom pot emetre una gamma de colors de llum diferent. Si aquesta llum és separada per un prisma o una xarxa de difracció, cada color és vist com una línia d’emissió en l’espectre, anomenada línia espectral .
Per demostrar com es forma una línia d’emissió, vegem què passa quan posem una mica de sal de taula comuna (clorur de sodi, NaCl) en la flama d’una espelma. Les fotos de dalt mostren l’espectre continu de la flama; és igual que el de la bombeta incandescent. Quan es posa una mica de sal de taula sobre un ganivet i l’hi sosté en la flama, apareix una línia taronja en l’espectre, que correspon a la línia d’emissió del sodi (Na, a 589 nm).
Un àtom no només emet llum, sinó també absorbeix fotons de la mateixa energia que emet. Si la llum passa a través d’un gas fred i de baixa densitat, els àtoms en el gas absorbeixen certes freqüències, el que forma línies fosques en l’espectre trucades línies d ‘absorció .
Els tres tipus d’espectres i els seus orígens. Els sòlids, els fluids i els gasos d’alta pressió emeten un espectre continu (a dalt). En la il·lustració del medi es mostra un gas calent de baixa densitat que emet un espectre de línies. Finalment, quan la llum amb un espectre continu passa a través d’un gas fred de baixa densitat, els colors específics de la llum són absorbits, deixant línies fosques en un espectre d’absorció (a baix). Faci click sobre la imatge per ampliar
Imatge cortesia de Mark Tiele Westra
Però si tots els espectres estan formats per àtoms que emeten colors molt definits, com es formen els espectres continus? Per a un sol àtom no afectat per factors externs, les línies són ben definides. Això és el que succeeix amb un gas de baixa densitat, per exemple en un tub fluorescent. En un gas d’alta pressió, per exemple el Sol, i també en fluids i sòlids, hi ha col·lisions freqüents i molts altres mecanismes que fan que les línies perdin la seva definició i es tornin borroses, formant un espectre continu . En la il·lustració de més avall hi ha una síntesi dels tres tipus d’espectres.
Els àtoms (i molècules) diferents tenen diferents espectres d’emissió i absorció. Podem aprofitar aquesta diferència: en mirar la llum que ve d’un objecte distant, per exemple del Sol o d’una estrella, es pot saber quins elements químics són presents. A la Terra, s’usa aquesta tècnica per donar a llum una mostra (sovint un gas) i mesurar l’espectre d’absorció, i així deduir la composició de la mostra.
L’espectre solar
Si traiem el nostre espectròmetre fora, podem veure l’espectre de la llum solar. L’espectre, que es mostra més avall, a primera vista sembla continu. Però, si mirem més detingudament, podem identificar diverses línies fosques, causades per l’absorció dels àtoms de certes freqüències de llum en les capes externes del Sol i en l’atmosfera terrestre. La imatge de sota no li fa justícia a la potencialitat de l’espectròmetre casolà: a simple vista les línies d’absorció es veuen més detalladament.
Les línies d’absorció que observem en l’espectre solar es diuen línies de Fraunhofer . Joseph von Fraunhofer (1787 – 1826) va ser el primer a realitzar l’estudi sistemàtic i el mesurament acurada d’aquestes línies fosques, encara que no va ser el primer a observar-les. En total, va descobrir al voltant de 570 línies, a les quals va categoritzar i va nomenar.
L’espectre del Sol vist amb el nostre espectròmetre casolà. Les línies corresponen a: (1) hidrogen a 656 nm, (2) sodi a 589 nm, (3) ferro a 527 nm, (4) magnesi a 518 nm, (5) hidrogen a 486 nm, i (6) ferro i calci a 431 nm. Faci click sobre la imatge per ampliar
Imatge cortesia de Mark Tiele Westra
Al voltant de 1860, Kirchoff i Bunsen van descobrir que cada element químic està associat amb un conjunt de línies espectrals. Van deduir que les línies de Fraunhofer en l’espectre solar eren causades per l’absorció de certs colors de la llum en les capes externes del Sol. Algunes línies són també causades per l’absorció de llum que realitzen els àtoms en l’atmosfera terrestre, com ara el oxigen. Eventualment, l’estudi d’aquestes línies va portar al descobriment de l’element heli en el Sol, el que finalment va provar que l’energia del Sol prové de la fusió nuclear.
Versió d’alta resolució de l’espectre solar, que mostra una multitud de línies Fraunhofer. La longitud d’ona augmenta d’esquerra a dreta, i després de baix a dalt. Faci click sobre la imatge per ampliar
Imatge cortesia del National Optical Astronomy Observatory / Association of Universities for Research in Astronomy / National Science Foundation
Agraïments
Li estic molt agraït a Xiaojin Zhu de la Universitat de Wisconsin-Madison, el lloc web em va brindar tota la informació necessària per construir el meu propi espectròmetre i per interpretar els resultats. Hi ha més espectres disponibles en aquest lloc web. També agraeixo a Bartjan van der Meer, que em va donar pistes sobre aquest meravellós projecte de ciència.